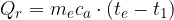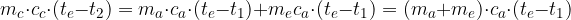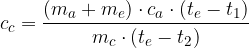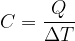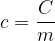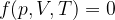Calore e temperatura sono due grandezze fisiche ben distinte.
La temperatura è la proprietà che regola il trasferimento di energia termica (cioè del calore). Il calore è una forma di energia che fluisce da un corpo più caldo verso un corpo più freddo, ed è la causa delle variazioni di temperatura: un corpo quando riceve calore si scalda e di conseguenza la sua temperatura aumenta, al contrario, un corpo quando perde calore si raffredda e perciò la sua temperatura diminuisce.

Trasferimento del calore dal corpo più caldo al più freddo
Il calore e la temperatura sono due proprietà ben definite e in stretta relazione con la struttura della materia.
Lo stato termico di un corpo può essere descritto tramite la temperatura.
La stessa quantità di calore in corpi diversi può produrre effetti diversi, cioè stati termici diversi. Possiamo fare un'analogia per chiarire meglio il concetto.
Ad esempio la stessa quantità di liquido in recipienti diversi raggiunge livelli diversi. Oppure si possono avere corpi che con quantità di calore diverse raggiungono la stessa temperatura come diverse quantità di liquido raggiungono lo stesso livello in recipienti diversi.
Secondo l'analogia la quantità di liquido corrisponde alla quantità di calore e il livello raggiunto alla temperatura.
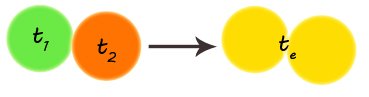
Quando due corpi a temperatura diversa sono messi in contatto, inizia uno scambio di calore dal corpo a temperatura maggiore al corpo a temperatura minore. Lo scambio di calore finisce quando i corpi raggiungono la stessa temperatura, cioè raggiungono l'equilibrio termico:
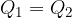 quando
quando 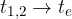
Esempio
Gli esempi sono visibili solo per gli utenti registrati
Registrati per vedere gli esempi »
Per l'accesso gratuito agli esercizi è necessario compilare il tuo profilo.
Completa il tuo profilo »
Misura della temperatura
La misura della temperatura non è una misura effettuata direttamente sul corpo come può invece avvenire per misurare una lunghezza. Per ottenere un valore sfruttiamo il concetto di equilibrio termico; infatti la temperatura di un corpo viene eseguita tramite uno strumento tarato contenente un liquido che messo a contatto col corpo in oggetto ne assume la stessa temperatura.
Tale strumento tarato è il termometro.

Varie tipologie di termometro
I termometri che utilizziamo sono normalmente costituiti da un tubicino (canna termometrica) di vetro che termina con un rigonfiamento (bulbo) riempito di un liquido (spesso mercurio) che, al crescere della temperatura, aumenta il proprio volume salendo all'interno della canna (secondo il fenomeno della dilatazione termica).
Per stabilire la scala di temperatura è necessario stabilire per ogni stato termico il volume di mercurio corrispondente. Vengono scelte perciò due temperature di riferimento, facilmente riproducibili, in modo da poter segnare sulla canna termometrica dei punti fissi. Nel XVIII secolo l’astronomo svedese Celsius scelse come temperature di riferimento la temperatura del ghiaccio in fusione (posta arbitrariamente pari a 0°C) e la temperatura dell’acqua in ebollizione (posta a 100 °C) dividendo poi l'intervallo in cento parti uguali. In questo modo definì il grado centigrado (o grado Celsius °C).
Per tarare un termometro secondo i gradi centigradi quindi è necessario metterlo a contatto con del ghiaccio (e segnare la tacca corrispondente agli zero gradi) e con i vapori dell'acqua in ebollizione (e segnare la tacca dei cento gradi).
Esistono anche altre scala termometriche. Ad esempio nei paesi anglosassoni è comunemente utilizzata la scala Fahreneit.
Nella scala Fahrenheit il congelamento dell'acqua avviene a 32°F mentre l'ebollizione avviene a 212°F. Per passare da Fahrenheit a Celsius e viceversa è sufficiente una semplice conversione:
Da gradi Fahreneit a gradi Celsius: 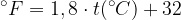
Da gradi Celsius a gradi Fahreneit: 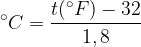
In entrambe le scale Celsius e Fahrenheit è possibile scendere sotto gli zero gradi. Anche a temperature inferiori agli zero gradi le molecole di cui è composta la materia continuano a muoversi ed agitarsi finché abbassandosi ancora la temperatura i movimenti non cesseranno del tutto. Sotto questa temperatura non si può andare perché la velocità delle particelle della materia non può andare sotto lo zero.
Questo punto di immobilità assoluta di tutti i costituenti microscopici della materia viene chiamato zero assoluto.
La temperatura dello zero assoluto corrisponde a -273,15° C.
Per questo motivo la scala di temperatura del Sistema Internazionale è la scala Kelvin, nella quale lo zero corrisponde allo zero assoluto.
Un grado kelvin corrisponde esattamente ad un grado centigrado, ma lo zero è stato spostato verso il basso a -273,15 °C. Quindi per fare la conversione tra queste due scale è necessario sommare o togliere 273,15:
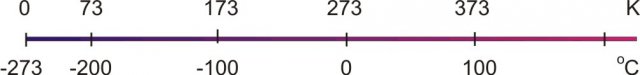
Corrispondenza tra gradi Celsius e scala Kelvin
Misura del calore
Il calore è una forma di energia e misurabile ed è definita come la quantità di calore necessaria per portare la temperatura di 1 g di acqua distillata da 14,5 °C a 15,5 °C, a pressione atmosferica (1 atm o 101,325 Pa).
L'unità di misura nel Sistema Internazionale è il Joule [J], ma è comunque ancora in uso anche la caloria [cal].
La relazione tra caloria e joule è data da:
Lo strumento per misurare le quantità di calore cedute o assorbite da un corpo o da una sostanza è il calorimetro. Il calorimetro è costituito da un recipiente isolato termicamente, che contiene una massa nota di acqua della quale si conosce la temperatura. Si basa sul principio della conservazione dell'energia, che in questo caso significa che tutto il calore assorbito o ceduto dall'acqua contenuta nello strumento resta all'interno dello strumento stesso e di conseguenza viene utilizzata per innalzare la sua temperatura. Mediante un termometro inserito nel calorimetro si misurano le variazioni di temperatura, legate al calore assorbito o ceduto attraverso la relazione:
In base alla relazione fondamentale della calorimetria:
possiamo scrivere le espressioni relative al calore acquistato dall'acqua e dal corpo:
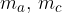 sono le masse dell'acqua e del corpo
sono le masse dell'acqua e del corpo
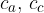 sono i calori specifici dell'acqua e del corpo
sono i calori specifici dell'acqua e del corpo
La quantità di calore assorbita dal calorimetro di solito viene fornito come dato tecnico dai produttori . Possiamo però calcolare quale massa di acqua, in pari condizioni, assorbirebbe la stessa quantità di calore; tale massa si chiama massa equivalente del calorimetro:
La prima equazione diventa allora:
che è il calore specifico del corpo.
Il calore specifico dell'acqua è per definizione: 1 cal/(g °C) o equivalentemente 4,18 J / (g °C)
Esempio
Gli esempi sono visibili solo per gli utenti registrati
Registrati per vedere gli esempi »
Per l'accesso gratuito agli esercizi è necessario compilare il tuo profilo.
Completa il tuo profilo »
La capacità termica
La capacità termica C di un corpo è il rapporto tra il calore Q che bisogna fornire ad un corpo per variarne la temperatura di una certa quantità e la variazione di temperatura stessa:
La sua unità di misura è il [J/K].
Esempio
Gli esempi sono visibili solo per gli utenti registrati
Registrati per vedere gli esempi »
Per l'accesso gratuito agli esercizi è necessario compilare il tuo profilo.
Completa il tuo profilo »
Il calore specifico
Il calore specifico c di una sostanza è il rapporto tra la capacità termica C della sostanza e la sua massa:
La sua unità di misura è il [J/(kg K)].
Esempio
Gli esempi sono visibili solo per gli utenti registrati
Registrati per vedere gli esempi »
Per l'accesso gratuito agli esercizi è necessario compilare il tuo profilo.
Completa il tuo profilo »
La Termodinamica
La termodinamica ha come argomento principale lo studio degli scambi di energia tra il sistema e l'ambiente.
Il sistema termodinamico è l'insieme di uno o più corpi di cui non interessa il comportamento del singolo ma solo il comportamento globale. Ad esempio ci interessa la pressione di un gas, non la pressione di ogni singola molecola.
Il sistema termodinamico è caratterizzato dal suo stato termodinamico, descritto dalle coordinate termodinamiche ( le grandezze macroscopiche attraverso le quali si descrivono le proprietà del sistema).
Un sistema termodinamico può essere, ad esempio, una quantità di gas. Le sue coordinate termodinamiche possono essere il volume, la pressione e la temperatura.
Le coordinate termodinamiche (come possiamo constatare anche dalle nostre esperienze quotidiane) non sono indipendenti ma sono legate tra loro da una relazione chiamata equazione di stato:
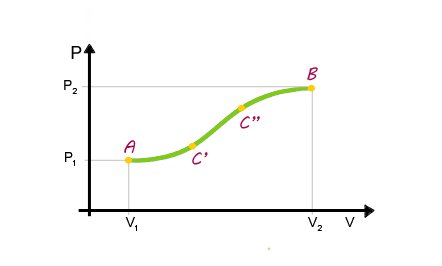
Ogni stato termodinamico può essere rappresentato nel Piano di Clapeyron.
Per un gas possiamo fissare la temperatura e rappresentare i punti caratteristici dei suoi stati (V,p)
Il punto A nel piano individua uno stato termico di un gas caratterizzato da un certo volume e pressione. Se il sistema passa da uno stato iniziale A a uno stato finale B (definito da valori diversi) si dice che il sistema ha subito una trasformazione passando da una successione di stati intermedi C', C",....
Sistema, ambiente ed universo
Ricordiamo alcune definizioni di base:
Universo termodinamico: è costituito dall'ambiente e dal sistema termodinamico (l'oggetto di studio).
Ambiente esterno: rappresenta la parte di universo che all'infuori del sistema. L'ambiente è separato dal sistema da una superficie di controllo. I bordi della superficie di controllo possono essere:
adiabatici: non consentono lo scambio di calore
diatermici: consentono lo scambio di calore
rigidi:non consentono lo scambio di lavoro
flessibili: consentono lo scambio di lavoro
permeabili: consentono il passaggio di ogni specie chimica
impermeabili non consentono il passaggio di alcuna specie chimica.
Sistema termodinamico: è l'oggetto di studio localizzato in una parte qualunque dell'universo, è nel sistema che avvengono le trasformazioni interne e scambi di materia o energia con l’ambiente esterno. Il sistema può essere:
aperto se ci sono sia scambi di energia (calore e lavoro) che di massa con l'ambiente.
chiuso se ci sono solo scambi di energia
isolato se non scambia né energia né materia
Quindi un sistema aperto ha bordi permeabili o semipermeabili, diatermici e flessibili, mentre un sistema isolato ha bordi impermeabili, rigidi e adiabatici.
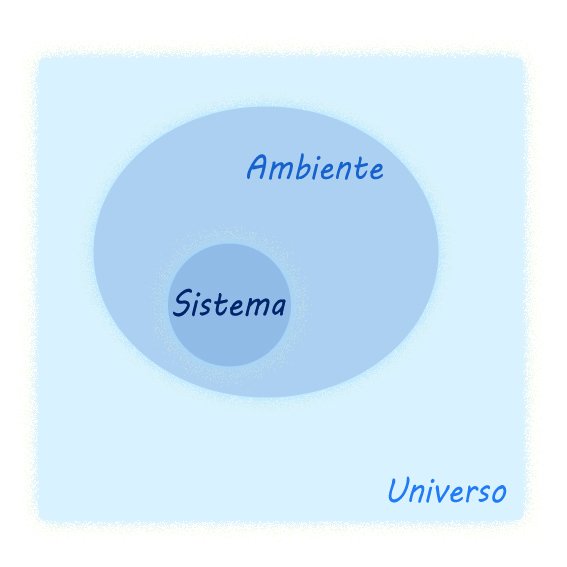
Universo - Ambiente - Sistema
Infine lo stato del sistema è definito dal valore delle coordinate termodinamiche, che nel caso di un gas sono p,V,T: pressione volume e temperatura.
Tipi di trasformazione
Una trasformazione è il passaggio da uno stato ad un altro modificando le coordinate termodinamiche.
Ci sono infinite trasformazioni che mutano le coordinate termodinamiche di un sistema durante il processo, ce ne sono però alcune particolari che meritano uno studio particolare:
Trasformazione isobara: si ha quando la pressione rimane costante durante tutto il processo. Sul piano di Clapeyron è rappresentata da un segmento parallelo all'asse del volume.
Trasformazione isocora: si ha quando il volume rimane costante durante tutto il processo. Sul piano di Clapeyron è rappresentata da un segmento parallelo all'asse della pressione.
Trasformazione isoterma: si ha quando la temperatura rimane costante durante tutto il processo. Per un gas ideale sul piano di Clapeyron è rappresentata da un arco di iperbole avente gli assi come asintoti.
Trasformazione adiabatica: si ha quando non c'è scambio di calore tra il sistema e l'ambiente.
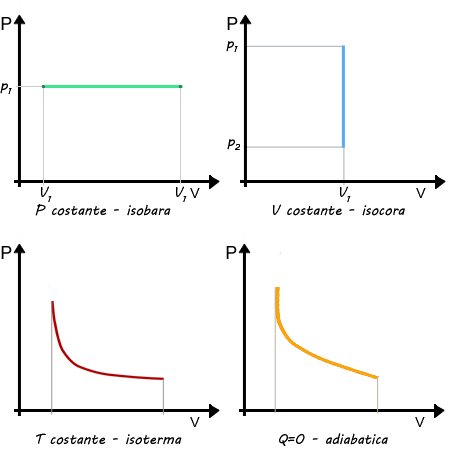
Trasformazioni termodinamiche
Questo argomento verrà trattato in dettaglio nel capitolo sui gas perfetti.





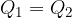 quando
quando 

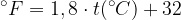
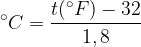
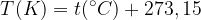
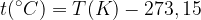

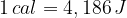
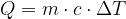
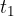 ) il corpo di calore specifico incognito, dopo averlo portato a temperatura
) il corpo di calore specifico incognito, dopo averlo portato a temperatura 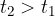 si attende che giunga a un nuovo equilibrio termico. L'agitatore A serve per accelerare il raggiungimento dell'equilibrio. Dopo di che si può leggere la temperatura finale di equilibrio
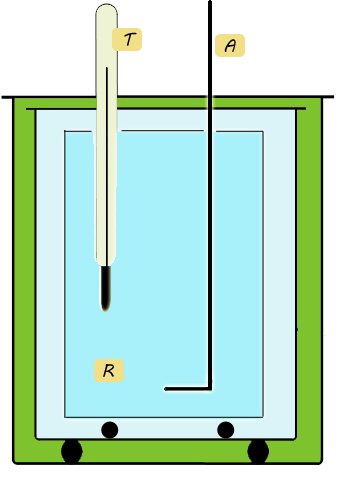
si attende che giunga a un nuovo equilibrio termico. L'agitatore A serve per accelerare il raggiungimento dell'equilibrio. Dopo di che si può leggere la temperatura finale di equilibrio 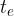 .
.
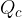 ceduto dal corpo è stato acquistato in parte dall'acqua
ceduto dal corpo è stato acquistato in parte dall'acqua 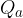 e, in piccola parte dal recipiente
e, in piccola parte dal recipiente 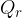 . Possiamo perciò scrivere:
. Possiamo perciò scrivere: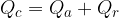
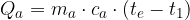

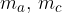 sono le masse dell'acqua e del corpo
sono le masse dell'acqua e del corpo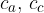 sono i calori specifici dell'acqua e del corpo
sono i calori specifici dell'acqua e del corpo