La materia è costituita da particelle elementari dette atomi. Essi sono raramente liberi in natura, e sono generalmente combinati, tramite forze elettriche, in gruppi più grandi detti molecole. Le molecole possono essere composte da atomi sia della stessa sostanza che di sostanze diverse.
Esempio
Gli esempi sono visibili solo per gli utenti registrati
Registrati per vedere gli esempi »
Per l'accesso gratuito agli esercizi è necessario compilare il tuo profilo.
Completa il tuo profilo »
Gli atomi sono a loro volta composti da tre particelle, dette per l'appunto subatomiche:
Il numero di elettroni e protoni è lo stesso, in modo che l'atomo sia complessivamente neutro. Il numero di protoni (denominato anche numero atomico Z) determina l'elemento, mentre il numero di elettroni determina le proprietà chimiche dell'atomo. I neutroni invece possono variare di numero, determinando così la radioattività dell'atomo. Gli elementi con stesso numero atomico e diverso numero di neutroni sono detti isotopi dello stesso elemento. Usiamo la simbologia 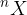 dove n è il numero di protoni e neutroni insieme (detto anche numero di massa A) e X il simbolo dell'elemento.
dove n è il numero di protoni e neutroni insieme (detto anche numero di massa A) e X il simbolo dell'elemento.
Esempio
Gli esempi sono visibili solo per gli utenti registrati
Registrati per vedere gli esempi »
Per l'accesso gratuito agli esercizi è necessario compilare il tuo profilo.
Completa il tuo profilo »
Massa di atomi e molecole
Abbiamo visto che le masse delle particelle subatomiche misurate in chilogrammi o in grammi sono piccolissime. Non è conveniente, perciò, praticamente usare numeri così piccoli. Si è pensato quindi di usare masse atomiche relative, cioè masse atomiche espresse in rapporto ad una massa di riferimento.
Allora, è stata scelta una opportuna massa di riferimento detta unità di massa atomica u (detta anche Dalton). Essa corrisponde alla dodicesima parte della massa dell'isotopo 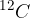 del carbonio, che è pari a:
del carbonio, che è pari a:
La massa atomica relativa indica quante unita di massa atomica ci stanno nella massa reale dell'atomo, cioè:
Da questa relazione, possiamo anche esprimere la massa reale in funzione della massa relativa:
Per quanto riguarda la massa delle molecole, essa altro non è che la somma della massa dei singoli atomi che la compongono, cioè per una molecola composta da n atomi:
La massa atomica è data dalla relazione:
ed 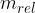 è la massa relativa dell'atomo (è segnata per ogni atomo nella tavola periodica).
è la massa relativa dell'atomo (è segnata per ogni atomo nella tavola periodica).
La massa di una molecola è la somma delle masse che la compongono.
Esempio
Gli esempi sono visibili solo per gli utenti registrati
Registrati per vedere gli esempi »
Per l'accesso gratuito agli esercizi è necessario compilare il tuo profilo.
Completa il tuo profilo »
Numero di Avogadro
nel nostro caso (ricordiamo che la massa del carbonio è 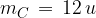 ):
):
Questo numero particolare è detto numero di Avogadro 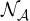 .
.
Possiamo ora definire un'altra importante grandezza notevole: la mole.
La mole è la quantità di sostanza che contiene tante entità elementari (atomi o molecole) quanti sono gli atomi presenti in 12 g di carbonio 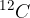 , cioè la quantità che contiene
, cioè la quantità che contiene 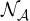 atomi o molecole. In formule:
atomi o molecole. In formule:
La mole n per i chimici è una grandezza fondamentale, ma non lo è per i fisici in quanto come visto può essere ricavata dal rapporto tra la massa della sostanza e la massa atomica.
La massa di una mole è detta massa molare 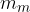 e si misura in
e si misura in 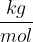 , ossia:
, ossia:
Quindi la massa molare è la massa relativa misurata in grammi.
Esempio
Gli esempi sono visibili solo per gli utenti registrati
Registrati per vedere gli esempi »
Per l'accesso gratuito agli esercizi è necessario compilare il tuo profilo.
Completa il tuo profilo »




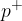 : si trovano nel nucleo dell'atomo ed hanno una carica positiva, a cui è attribuito il valore +1. Hanno una massa pari a circa
: si trovano nel nucleo dell'atomo ed hanno una carica positiva, a cui è attribuito il valore +1. Hanno una massa pari a circa 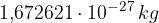 ;
;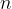 : si trovano, come i protoni, nel nucleo ma non hanno carica elettrica (appunto neutroni). Hanno un massa di
: si trovano, come i protoni, nel nucleo ma non hanno carica elettrica (appunto neutroni). Hanno un massa di 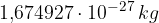 molto simile a quella del protone.
molto simile a quella del protone.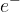 :essi ruotano attorno al nucleo e hanno carica uguale ma opposta al protone -1. Essi hanno una massa di
:essi ruotano attorno al nucleo e hanno carica uguale ma opposta al protone -1. Essi hanno una massa di 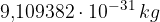 , cioè1836 volte inferiore a quella del protone, contribuiscono alla massa totale dell'atomo per meno dello 0,06%.
, cioè1836 volte inferiore a quella del protone, contribuiscono alla massa totale dell'atomo per meno dello 0,06%.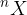 dove n è il numero di protoni e neutroni insieme (detto anche numero di massa A) e X il simbolo dell'elemento.
dove n è il numero di protoni e neutroni insieme (detto anche numero di massa A) e X il simbolo dell'elemento.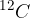 del carbonio, che è pari a:
del carbonio, che è pari a: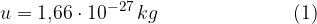

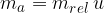
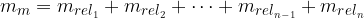
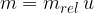
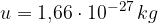
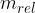 è la massa relativa dell'atomo (è segnata per ogni atomo nella tavola periodica).
è la massa relativa dell'atomo (è segnata per ogni atomo nella tavola periodica).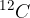 e vogliamo sapere da quanti
e vogliamo sapere da quanti 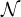 atomi di
atomi di 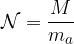
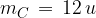 ):
):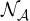 .
.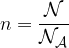
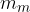 e si misura in
e si misura in 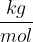 , ossia:
, ossia:


